PRACTICAS DE MICROBIOLOGÍA ENOLÓGICA - RECUENTO DE LEVADURAS (MÉTODO DE LAS DILUCIONES)
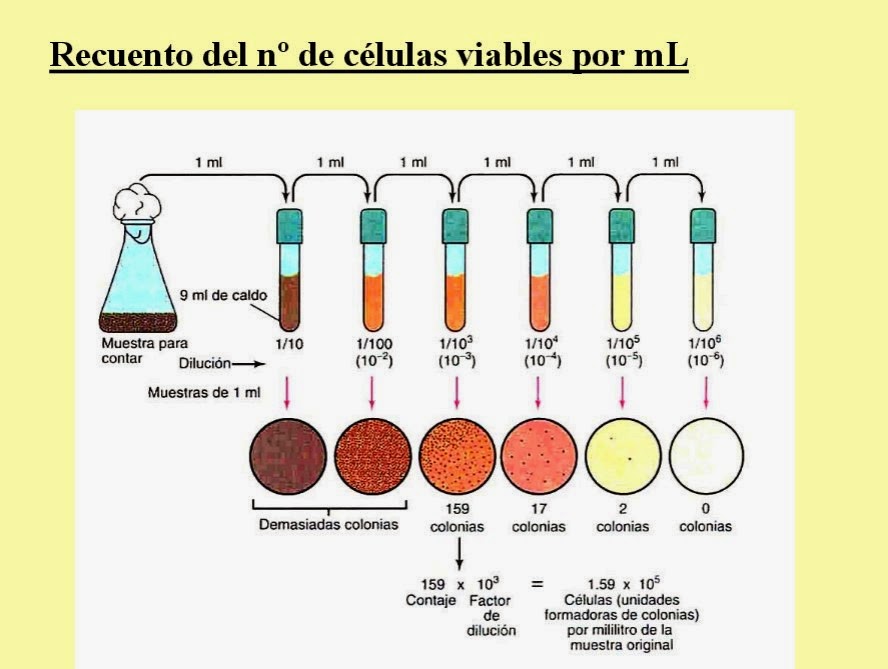
- Levaduras Viables (Método de las Diluciones): El objetivo es hacer un recuento de células viables, en este caso de levaduras, practicando diluciones sucesivas de la muestra para sembrar un determinado volumen de las mismas en medios de cultivo específicos.
Conociendo el número de colonias que crecen en el medio, el inóculo utilizado y la dilución podemos determinar las UFC/ml de la muestra inicial. En muy importante partir de una dilución adecuada para obtener colonias perfectamente separadas, que puedan contarse fácilmente (una cantidad correcta serían 100-150 colonias).
UFC/ml = nº colonias X 10 X f. dilución
- Levaduras Totales (Cámara de Neubauer): Para el recuento de levaduras totales: viables + muertas, se utiliza la cámara de Neubauer que tiene una capacidad de 0.3 mm3 y permite y permite realizar el conteo de microorganismos a través de una cuadrícula (400 cuadraditos) impresa en la cámara. Se obtiene el número aproximado de UFC/ml.
UFC/ml = nº colonias X 10000 X f.dilución
- En el recuento, para evitar errores: Las células que están sobre las líneas de los cuadrados horizontales se consideran como pertenecientes al cuadrado inferior; las que están en las líneas verticales corresponderán al cuadrado de la derecha. Las gemaciones se consideran como media levadura; Es importante que el número de levaduras/cuadrado en un rango fácil para contar, un buen número sería 5-7 levaduras; La limpieza de la cámara y su cubreobjetos se hace con agua destilada estéril teniendo mucho cuidado también en el secado para evitar que se raye.
1.- RECUENTO DE LEVADURAS VIABLES. MÉTODO DE LAS DILUCIONES
- Objetivo: El objeto de esta práctica es realizar el recuento de levaduras viables, mediante la realización de diluciones sucesivas de la muestra y la siembra de un determinado volumen de las mismas en medios de cultivo específicos.
Es importante partir de una dilución adecuada para obtener colonias que puedan contarse fácilmente. Un número adecuado es de 30 a 300 colonias.
- Dilución en serie: Una dilución en serie es la reducción progresiva, paso a paso, de la concentración de una sustancia en disolución. Por lo general, el factor de dilución en cada paso es constante, lo que da como resultado una progresión geométrica de la concentración, en forma logarítmica. Las diluciones en serie se utilizan para crear disoluciones muy diluidas con precisión, así como disoluciones para experimentos en los que se pretenda estudiar curvas de concentración con una escala logarítmica. Las diluciones en serie son ampliamente utilizadas en las ciencias experimentales, incluyendo bioquímica, química, farmacología, microbiología y física, así como en la homeopatía.
En biología, además de los usos convencionales, la dilución en serie también se puede utilizar para reducir la concentración de microorganismos o células de una muestra. Como, por ejemplo, el número de colonias que crecen en una placa de Petri en un momento dado depende de la concentración, y dado que muchas otras técnicas de diagnóstico implican contar físicamente el número de microorganismos o células en ciertas áreas impresas dentro de una rejilla (comparando las concentraciones de dos tipos de células o microorganismos en la muestra) o en cavidades de un volumen determinado (para concentraciones absolutas), la dilución puede ser útil para obtener resultados más manejables o para tener un número definido de colonias de cultivo en cada placa. La dilución en serie es también un método más barato y más sencillo para preparar los cultivos de una sola célula que el empleo de pinzas ópticas y micromanipuladores.
MATERIAL
- Tubos con el medio cloranfenicol glucosa agar: Es uno de los principales medios de cultivo para levaduras.
. Cloranfenicol-glucosa-agar: Se comercializa liofilizada y se utiliza para recuento de levaduras viables. Contienen Cloranfenicol, es un antibiótico de amplio espectro para bacterias.
. Agar lisina: Se utiliza para determinar si hay levaduras no saccaromyces (este medio tiene lisina como única fuente de carbono, las saccharomyces no pueden utilizarlo y no crecen).
. Agar Sabouraud: Saboraud agar y caldo. Medio sólido y liquido. El agar Sabouraud es un tipo de medio de cultivo selectivo que contiene peptonas. Es utilizado para el cultivo de hongos, especialmente dermatofitos, aunque también pueden desarrollarse en él cierto tipo de bacterias filamentosas tales como Nocardia. En la actualidad el medio esta mejorando acercando el pH al neutro y disminuyendo el nivel de glucosa para permitir el crecimiento de otros subcultivos de hongos. Composición típica: 40 g/L glucosa; 10 g/L pluripeptona; 15 g/L agar; 0,05 g/L (cloranfenicol),; pH 5.6
. Agar-agar: El agar o agar-agar es una gelatina vegetal de origen marino. Es un polisacárido sin ramificaciones obtenido de la pared celular de varias especies de algas de los géneros Gelidium, Euchema y Gracilaria, entre otros, resultando, según la especie, de un color característico. La palabra “agar” viene del malayo agar-agar, que significa jalea. También es conocido por los nombres “gelosa”, “gelosina”, “gelatina vegetal”, “gelatina china” o “gelatina japonesa”.
Químicamente, el agar es un polímero de subunidades de galactosa; en realidad es una mezcla heterogénea de dos clases de polisacáridos: agaropectina y agarosa. Aunque ambas clases de polisacáridos comparten el mismo esqueleto de galactosa, la agaropectina está modificada con grupos ácidos, tales como sulfato y piruvato. Los polisacáridos de agar sirven como la estructura primaria de la pared celular de las algas. Disuelto en agua caliente y enfriado se vuelve gelatinoso. Su uso principal es como medio de cultivo en microbiología, otros usos son como laxante, espesante para sopas, gelatinas vegetales, helados y algunos postres y como agente aclarador de la cerveza.
El agar nutritivo es usado como medio de cultivo para el crecimiento de bacterias y hongos, pero no para virus (aunque los virus bacteriófagos crecen frecuentemente en bacterias cultivadas en agar).
- Tubos con la suspensión de las levaduras: El tubo de ensayo es parte del material de vidrio de un laboratorio de química. Consiste en un pequeño tubo cilíndrico sirve para calentar sustancias tambien puede soportar grandes temperaturas gracias al material que está hecho de vidrio con un extremo abierto (que puede poseer una tapa) y el otro cerrado y redondeado, que se utiliza en los laboratorios para contener pequeñas muestras líquidas o sólidas, aunque pueden tener otras fases, como realizar reacciones químicas en pequeña escala. Entre ellos está el exponer a temperatura el mismo contenedor. Se guardan en un instrumento de laboratorio llamado gradilla. Los tubos de ensayo están disponibles en una multitud de tamaños, comúnmente de 1 a 2 cm de ancho y de 5 a 20 cm de largo.
- 7 tubos con 9 ml de solución salina estéril: La solucion salina es cloruro sódico al 0.9% en agua destilada o desionizada, estéril y apirógena. Esta disolución acuosa y salina es compatible con los organismos vivos debido a sus características definidas de osmoticidad, pH y fuerza iónica.
- Micropipetas y puntas estériles: La micropipeta es un instrumento de laboratorio empleado para succionar y transferir pequeños volúmenes de líquidos y permitir su manejo en las distintas técnicas analíticas.
Los volúmenes captables por estos instrumentos varían según el modelo: los más habituales, denominados p20, p200 y p1000, admiten un máximo de 20, 200 y 1000 μl, respectivamente.
Es de destacar que el uso de micropipetas permite emplear distintos líquidos sin tener que lavar el aparato: para ello, se emplean puntas estériles: puntas desechables, de plástico, que habitualmente son estériles. Existen varios tipos de puntas: por ejemplo, las amarillas para pipetear volúmenes pequeños (por ejemplo, 10 μl), y las azules para pipetear volúmenes grandes (por ejemplo, 800 μl).
Existen micropipetas manuales, en las que el volumen a aspirar se fija girando un botón en su parte superior que está conectado a un sistema analógico de confirmación de volumen, y automáticas, en las cuales dicho sistema es digital.
Hay micropipetas simples, que sólo acogen una punta cada vez, y multicanales, que permiten incorporar múltiples puntas (por ejemplo, ocho), absorbiendo el mismo volumen en todas ellas.
- Baño de agua s 50 ºC: El agua caliente sanitaria (ACS) es agua destinada a consumo humano (potable) que ha sido calentada. Se utiliza para usos sanitarios (baños, duchas, etc.) y para otros usos de limpieza (fregado de platos, lavadora, lavavajillas, fregado de suelos). Normalmente el agua procede de la instalación de agua del edificio.
METODO
Utilización de ajentes físicos para la sterilización del material de laboratorio.
- Por radiaciones: Algunas radiaciones electromagnéticas son letales para las células microbianas. Las radiaciones de longitud de onda más larga que la luz visible (infrarrojos...) son de bajo poder energético y por sí mismas no son letales para los microorganismos pero generan calor que, indirectamente y según la dosis, puede tener un efecto bactericida. Las radiaciones de longitud más corta que la luz visible son muy germicidas. Incluyen la luz ultravioleta (la más utilizada) y las radiaciones ionizantes (rayos X, gamma y cósmicos) que sólo pueden ser aplicadas a la esterilización de ambientes y superficies debido a su prácticamente nula penetración.
- Incineración: Es una de las formas más comunes de esterilizar los objetos empleados durante la manipulación aséptica de los microorganismos. En las llamas de los mecheros Bunsen se alcanzan temperaturas superiores a los 2500°C, por lo que una breve exposición es suficiente.
- Autoclave: Es un recipiente de presión metálico de paredes gruesas con un cierre hermético que permite trabajar a alta presión para realizar una reacción industrial, una cocción o una esterilización con vapor de agua. Su construcción debe ser tal que resista la presión y temperatura desarrollada en su interior. La presión elevada permite que el agua alcance temperaturas superiores a los 100 °C. La acción conjunta de la temperatura y el vapor produce la coagulación de las proteínas de los microorganismos, entre ellas las esenciales para la vida y la reproducción de éstos, hecho que lleva a su destrucción.
Instrucciones para el uso del autoclave en frío:
. Abrir la tapa superior.
. Verificar que las válvulas de vapor y desagüe están cerradas.
. Comprobar que el nivel del agua alcanza la gradilla. En caso contrario, añadir
más agua hasta alcanzar el nivel.
. Seleccionar la temperatura de esterilización 121°C, así como el tiempo de esterilización 20 minutos.
. Introducir el material a esterilizar y cerrar bien la tapa.
. Encender el autoclave. Una vez alcanzada la T3. Seleccionada, comienza a contar el tiempo de esterilización.
. Una vez que termina el ciclo de esterilización, suena una alarma. Para desconectarla, es necesario poner el interruptor en OFF.
Agitar bien la suspensión de levaduras cuyo recuento se pretende determinar.
- Agitador vórtex: Un agitador tipo vórtex o mezclador de vórtice es un dispositivo simple que se usa comúnmente en los laboratorios para agitar pequeños tubos o frascos de líquido. Se compone de un motor eléctrico con el eje de transmisión orientado verticalmente y unido a un trozo de goma o caucho montado en forma de copa, ligeramente excéntrico. A medida que el motor gira la pieza de caucho oscila rápidamente en un movimiento circular. Cuando un tubo de ensayo o recipiente adecuado se coloca en el soporte de goma (o toca su borde) el movimiento se transmite al líquido en su interior y se crea un vórtice. La mayoría de los mezcladores de vórtice tienen una configuración de velocidad variable y pueden ser configurado para ejecutarse de forma continua, o para que funcione sólo cuando una débil presión se aplica a la goma. Poseen unos pies de ventosa en la base para evitar desplazamientos.
Los agitadores tipo vortex son bastante comunes en los laboratorios de ciencias biológicas. En los laboratorios de cultivos celulares y de microbiología se pueden utilizar para suspender las células. En un laboratorio de bioquímica o de análisis puede ser utilizado para mezclar los reactivos de un ensayo o para mezclar una muestra experimental y un diluyente.
Numerar una serie de 7 tubos con 9 ml de solución salina estéril del 1 al 7.
- Método de las Diluciones: Vamos realizando diluciones 1/10 sucesivas, pasando 1 ml de la suspensión problema al tubo 1. Agitar bien y pasar 1 ml del tubo 1 al tubo 2 y así sucesivamente.
El tubo 1. tendrá una dilución 10-1, el tubo 2. 10-2, el tubo 3. 10-3, el tubo 4. 10-4, el tubo 5. 10-5, el tubo 6. 10-6, el tubo. 7, 10-7.
- Por bancada: Transferir 1 ml de la muestra directa y de los tubos 1, 2, 3, 4, 5, 6, y 7 a una placa petri vacía y estéril, añadir el medio de cultivo que está atemperado en el baño...
Mezclar el medio y agitar la placa 10 veces en sentido de las agujas del reloj y otras 10 en el sentido contrario.
También podemos tener placas con el medio solidificado, transferir 1 ml de la muestra y distribuir con un asa de digrasky estéril.
- Asa de digrasky estéril: Es un asa para siembra por diseminación en superficie, fabricada en poliestireno blanco y estéril por radiación. Longitud total: 145 mm y longitud de la base: 38 mm. La longitud de la base hace que sea apta para sembrar muestras líquidas en todo tipo de placas de Petri sin tocar las paredes de la placa. La punta inclinada a modo de apéndice final consigue que durante la extensión se reduzca al máximo la posibilidad de rotura del medio sólido.
Esperar a que solidifique e incubar en estufa a 25ºC, en posición invertida durante 48 horas. Seleccionar la placa que contenga un número de colonias entre 30-300 y utilizarlas para realizar los cálculos. Calcular UFC /ML
UFC/ml= nº colonias x dilución
EJEMPLO DE CÓMO CALCULAR UFC/ML
- Hay que hacer unas diluciones (10^-1, 10^-2....) y luego sembrar (10 microlitros, por ejemplo, q es igual a 0,1 mL) en un medio de cultivo esas placas.
- Dias despues, se observan y en la placa donde haya de unas 50 a 150 colonias, las cuentas (por ejemplo, 90 colonias).
- Para saber las UFC/ml solo hay que multiplicar el número de colonias que contamos con anterioridad, por la dilución en la que lo estamos contando (por ejemplo 10 elevado a -2) y por el inverso de los ml q sembramos: 90colonias x 1/0,1 mL x 1/10 elevado a -2= Estes será el numero de ufc/mL que habia en el inicio, antes de hacer las diluciones.
MUESTRAS PARA REALIZAR EL RECUENTO DE LEVADURAS VIABLES
- Mosto (antes y después de sulfitar)
- Mosto en Fermentación (diariamente o en las distintas fases)
- Mosto-Vino despues de la FOH (Fermentación Alcoholica)
- Vino Clarificado (después de la estabilización, clarificación, filtrado, embotellado...)
Nota: Utilizar un recipiente estéril y manipular todo lo más asépticamente posible.
NORMAS GENERALES DE TRABAJO EN EL LABORATORIO DE MICROBIOLOGIA
Un laboratorio de Microbiología es un lugar convenientemente habilitado donde se pueden manejar y examinar microorganismos. Este tipo de trabajo debe ser llevado a cabo con una buena técnica aséptica, y por tanto se requiere un ambiente limpio y ordenado y trabajar siempre en condiciones de esterilidad (en campanas de esterilidad biológica o en la proximidad de la llama de un mechero de alcohol o de gas).
Aunque los microorganismos que se manipulen no sean considerados patógenos, todos los cultivos de todos los microorganismos deben ser manejados con precaución por su potencial patogenicidad.
1. Es imprescindible el uso de bata de laboratorio.
2. Al iniciar y finalizar las prácticas, el estudiante se lavará las manos con agua y jabón.
3. El lugar de trabajo debe estar siempre limpio y ordenado. Antes de comenzar cada práctica es conveniente desinfectar la superficie de trabajo. Los desinfectantes más habituales para esto son la lejía y el alcohol (etanol 96°).
3. Los microorganismos deben manejarse siempre alrededor de la llama. Se deben evitar los desplazamientos innecesarios por el laboratorio, ya que pueden crear corrientes que originen contaminaciones o producir accidentes.
5. Durante las prácticas está prohibido comer, beber y filmar. Cuando se manipulan microorganismos hay que evitar llevarse las manos a la boca, nariz, ojos, etc.
6. Libros, caipetas, abrigos y cualquier otro material que no se utilice en la realización de la práctica deben estar apartados del lugar de trabajo.
7. Para deshacerse del material contaminado se utilizarán los recipientes adecuados, que serán esterilizados posteriormente. Nunca se debe tirar nada contaminado por la fregadera o a la basura común.
8. Bajo ningún concepto debe sacarse ninguna muestra contaminada del laboratorio.
9. No se debe pipetear nunca con la boca. Utilizar siempre pipeteadores manuales.
10. En caso de accidente (ruptura de material, derramamiento de microorganismos, etc.) se comunicará inmediatamente al instructor.
2.- REALIZAR EL RECUENTO DE LEVADURAS VIABLES Y PONERLAS EN COMÚN
2.1.- Calcula las UFC/ml si sembramos 100 μ l de vino con una dilución: 10-3, y realizamos un recuento en placa de 50 UFC.
2.2.- Calcula las UFC/ml si sembramos 500 μ l de vino con una dilución: 10-5, y realizamos un recuento en placa de 100 UFC.
3.- OBTENCION DE CULTIVOS PUROS O AXÉNICOS. AISLAMIENTO POR AGOTAMIENTO POR ESTRIAS
- Un cultivo puro: Es aquel que contiene una sola clase de microorganismos. Para obtenerlo es preciso recurrir a las llamadas técnicas de aislamiento. Para realizar estudios sobre las propiedades de un microorganismo es fundamental partir de un cultivo puro. Cada colonia o UFC que crece en un medio solido procede de una sola célula. Por lo que el cultivo descendiente de una colonia es un cultivo puro.
- Cultivo axénico: Un cultivo axénico consiste en una sola especie microbiana, proveniente de una sola célula. Los cultivos axénicos son muy extraños en la naturaleza. En los medios naturales como por ejemplo, en el suelo, agua, o en el cuerpo humano. Existen cultivos mixtos. En un cultivo mixto, existen muchas y diferentes especies de forma conjunta. Un cultivo axénico se obtiene artificialmente en un laboratorio. La obtención de un cultivo axénico consiste en dos etapas. La primera, hay que esterilizar todos los materiales para eliminar todos los microorganismos presentes en ellos.La segunda, hay que aislar y cultivar un solo microorganismo, para producir un clon de descendiente.
AISLAMIENTO POR AGOTAMIENTO POR ESTRIAS:
Es un método rápido y simple de agotamiento progresivo y continuo del inóculo sobre un medio sólido contenido en una placa petri.
El objetivo es obtener a partir de un elevado número de microorganismos, un número reducido distribuidos en la superficie de la placa. Al incubar cada microorganismo origina una colonia.
PROCEDIMIENTO
1.- Esterilizar el asa flameandola en el mechero hasta conseguir un rojo incandescente.
2.- Enfriar el asa en la proximidad de la llama. Tomar una porción de muestra.
3.-Transferir el inoculo a un área pequeña de la superficie de la placa, próxima al borde. Extenderlo formando estrías muy juntas.
4.-Flamear el asa y enfriarla.Rozar las estrias sembradas la priemra vez y realizar una segunda tanda de estrias sobre otra porción de la placa.
5.- Flamear y enfriar. Repetir la misma operación del punto anterior, rozando la segunda tanda de estrias.
6.- Tapar la placa petri e incubar a la Tª. Adecuada, en posición invertida (para evitar que el agua de condensación se deposite sobre la superficie del agar).
METODO
Para poder realizar estudios morfológicos y fisiológicos de una determinada cepa de levaduras, es necesario obtener un cultivo puro.
Partiendo de las colonias de levaduras obtenidas en la practica nº 3. (en cada placa puede haber diferentes especies de levaduras). Vamos a obtener un cultivo puro por la técnica de agotamiento por estrias.
Se realizará esta técnica descrita utilizando placas petri con el medio de cultivo Saboraud.
Las levaduras son abundantes y se encuentran en el suelo, sobre la vid o incluso en la bodega de elaboración. Gracias ha estos estudios de las levaduras en los diferentes estadios de elaboración del vino, se pueden seleccionar las mejores cepas de "Levaduras Vinicas" según sus diversas propiedades. También es posible mejorar este tipo de levadura por técnicas de ingeniería genética, con la finalidad de obtener un producto de mejor calidad y más uniforme.
4.- RECUENTO DE LEVADURAS TOTALES
- Cámara de Neubauer: Es un instrumento utilizado en medicina y biología para realizar el recuento de células en un medio líquido.
Esta cámara de recuento está adaptada al microscopio de campo claro o al de contraste de fases. Se trata de un portaobjetos que tiene dos zonas ligeramente deprimidas en cuyo fondo se ha marcado con la ayuda de un diamante una cuadrícula de dimensiones conocidas. Se cubre la cámara con un cubreobjetos que se adhiere por simple tensión superficial (en especial una vez que se haya añadido la muestra líquida).
Luego se introduce, por capilaridad entre la cámara y el cubre, el líquido con las células a contar, generalmente tras una dilución previa; puesto que la cámara tiene dos zonas esto permite hacer dos recuentos simultáneamente. Se observa la retícula al microscopio con el aumento adecuado y se cuentan las células.
A partir del número de células contadas, conociendo el volumen de líquido que admite el campo de la retícula, se calcula la concentración de células en la muestra líquida aplicada.
El cálculo de la concentración de células se puede expresar así:
Partículas / μl = (partículas contadas) / [ (superficie contada (mm²)∙profundidad de la cámara(mm) ] ∙ dilución.
En la retícula central, la cámara de Neubauer tiene un cuadrado primario que contiene nueve cuadrados secundarios, cada uno de ellos dividido a su vez en 16 cuadrados terciarios. El cuadrado secundario central contiene no 16, sino 25 cuadrados, cada uno de ellos dividido a su vez en 16 cuadrados cuaternarios. En los bordes de este cuadrado central se cuentan los hematíes, utilizando sólo los cuadrados de los bordes del terciario central y uno de los centrales. En los secundarios de los bordes superiores e inferiores de la cámara se hace el recuento leucocitario.
FUNDAMENTO
Para el recuento de levaduras totales (viables + muertas) se utiliza la cámara de Neubauer.
La cámara de Neubauer es una cuadricula de 256 cuadraditos (16x16). Cada cuadradito tiene una capacidad de 0.00025 mm3 (0.0025 mm2 x 0.1 mm).
Este método permite realizar recuentos y nos da un número aproximado de UFC/ml.
MATERIAL
- Suspensión de levaduras cuyo recuento se pretende realizar
- Cámara de Neubauer
- Microscopio
- Agitatubos
- Micropipeta
MÉTODO
Homogeneizar la suspensión de levaduras cuyo recuento se pretende determinar.
Depositar sobre la cuadricula de la cámara 2 gotas de suspensión. Cubrir la cámara con el cubreobjetos con cuidado de no producir burbujas de aire.
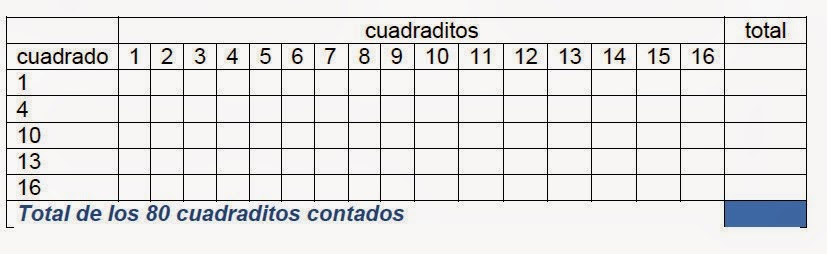
No es necesario contar los 256 cuadraditos, se van a contar 5 grupos (cuadrados) de 16 cuadraditos en áreas diferentes de la cámara.
Para realizar el contaje haya que tener en cuanta unas normas para evitar errores:
1.- Las células que están sobre las líneas horizontales de los cuadrados se consideran del cuadrado inferior. Si están en las líneas verticales se consideran del cuadrado de la derecha. Las gemaciones se consideran como media levadura.
2.- El número de levaduras por cuadradito se encontrará en un rango de fácil recuento ( 5-7 levaduras)
La limpieza de la cámara se realizará con sumo cuidado con agua destilado estéril.
CALCULOS
Hemos contado las levaduras que hay en 80 cuadraditos.
Sumar todas y dividir por 80, así tendremos la media de levaduras por cuadradito.
Nº levaduras/ml: nº (levaduras por cuadradito) x1000 x dilución/ 0.00025






![An American Tail [1986] [DVD5-R1] [Latino]](http://iili.io/FjktrS2.jpg)








